[摘要]目的 观察阿瓦斯汀对豚鼠阿尔兹海默病(Alzheimer’s disease,AD)微血管VEGF表达和微血管密度的作用。方法 将AD豚鼠随机分为假手术组、模型组、阿瓦斯汀组,除假手术组外,其余组均采用豚鼠颈总动脉内注射玉米粉,通过脑血管沉积淀粉蛋白,建立阿尔茨海默氏病动物模型。造模24h后,模型组和假手术组给予等容量血清静脉注射,均1次2周,连续30d。阿瓦斯汀组另给予阿瓦斯汀注射液5mg/kg,静脉注射,1次2周。干预结束后,Morris水迷宫检测各组豚鼠逃避潜伏期评价学习记忆能力,免疫组化法检测皮质及胼胝体VEGF和CD34表达情况,以CD34标记MVD。结果 与假手术组比较,阿瓦斯汀组豚鼠逃避潜伏期明显延长(P<0.05),胼胝体VEGF表达水平降低(P<0.05),皮质和胼胝体MVD显著降低(P均<0.05);与模型组比较,阿瓦斯汀组豚鼠逃避潜伏期延长(P<0.05),皮质及胼胝体VEGF表达水平、MVD均显著降低(P均<0.05)。结论 阿瓦斯汀能下调AD豚鼠脑组织VEGF表达,抑制脑组织血管生成,这可能是其加剧栓塞后AD样神经病理改变的机制之一。
关键词:阿瓦斯汀; 阿尔兹海默病;血管内皮生长因子;微血管密度
阿尔兹海默病(Alzheimer’s disease,AD)是引起老年性痴呆的常见神经退行性疾病。AD的主要病理改变包括大脑新皮质(特别是颞叶和额叶)细胞外淀粉蛋白沉积(extracellularamyloid deposition)为淀粉斑或老年斑(senile plaques)、神经元细胞内神经原纤维缠结(neurofibrillary tangles)ortau蛋白病变(tauopathy)、神经突起失营养性病变(neuritic dystrophy)、微(小)血管病变、神经胶质增生、以及神经元与突触丢失,严重威胁人类身心健康[1]。在近几十年的研究中,淀粉样蛋白级联假说占主导地位,该假说认为遗传或其他因素引起β-淀粉样蛋白(amyloid-βpeptide,Aβ)聚集形成纤维化沉积,进而形成β淀粉样斑块,随后tau蛋白过度磷酸化形成神经纤维缠结,并产生突触和神经元功能损伤,最终导致认知功能障碍[2]。淀粉样变性同时也导致微血管狭窄、栓塞,脑血流量减少,慢性持续性脑血流量下降使大脑参与认知的重要部位如额、颞叶皮质,海马以及白质区等长期处于缺血状态,逐渐出现认知功能障碍,改善和恢复局部的血供可能是治疗本病的关键。瓦斯汀(单克隆抗体)是美国食品与药品管理局(FDA)批准上市的抗癌新药(也用来治疗视网膜血管新生),其药理机制是阻断血管内皮生长因子(vascular endothelial growth factor VEGF) 的生理作用,从而抑制血管新生[3-4]。我们推测该药会干扰或延缓实验性微血管栓塞后血管的再生及修复,因而加剧栓塞后AD样神经病理改变。本次研究拟建立慢性脑缺血AD豚鼠模型,观察其对AD豚鼠皮质及胼胝体血管内皮生长因子(VEGF)表达及微血管密度(MVD)的影响,进一步探究其可能机制。
1实验资料
1.1实验动物雄性SD豚鼠24只,体质量(250±10)g,清洁级,由长沙医学院基础医学实验动物中心提供。
1.2主要药物 阿瓦斯汀注射液购自上海强生制药公司,批号:1103009
1.3主要试剂与仪器 VEGF单克隆抗体(Lot.GR58038-1)和CD34单克隆抗体(lot.GR55967-1)购自英国ABCAM公司。浓缩型DAB试剂盒(Lot.15111A03)购自北京中杉金桥生物技术有限公司。多功能真彩色细胞图像分析管理系统(美国MediaCybernetics公司),LEICARASP300全自动脱水机(德国徕卡公司),OLYMPUSCX41光学显微镜(日本Olympus公司)。
1.4实验方法 将SD豚鼠随机分为假手术组、模型组、阿瓦斯汀组,每组8只,3组豚鼠饲养环境相同。除假手术组外,其余组均采用豚鼠颈总动脉内注射玉米粉,通过脑血管沉积淀粉蛋白,建立阿尔茨海默氏病动物模型:用戊巴比妥钠(50 mg/kg)麻醉动物后,颈部皮肤消毒,旁正中切口暴露颈总动脉。用22号头皮针(带蝶翼,尾部连接铁弗龙taflon 导管)从尾侧向头侧方插入颈总动脉,用缝线将针管部分固定于周围组织,铁弗龙导管的另一端连3ml 的注射针筒。针筒安装入定速微量灌流仪(请见研究基础图二左上)。针筒内盛装新鲜配制的5%玉米粉生理盐水稀释液,按具体实验预设定的速度灌流玉米粉稀释或生理盐水。模型制备24h后,型组和假手术组给予等容量血清静脉注射,均1次2周,连续30d。阿瓦斯汀组另给予阿瓦斯汀注射液5mg/kg,静脉注射,1次2周。
1.5观察指标
1.5.1 Morris水迷宫逃避潜伏期干预结束后进行Morris水迷宫实验。Morris水迷宫装置参照文献,选用豚鼠通用型圆桶,在圆桶上缘设等距离的东、西、南、北4个标记点,将水面和水桶分成4个象限。实验时向水桶加水至37cm,水温控制在23-25°C,水内添加墨汁,使其呈黑色不透明状。先将豚鼠放人水池中进行自由游泳训练2min,使其熟悉环境。实验共历时4d,每天定于固定时间段,每个时间段训练4次。实验时,将高度为35cm、直径为8cm的平台设置于东北象限,将豚鼠先由远离平台的西南象限人水,然后分别由其他3个象限人水,至其找到平台,记录其逃避潜伏期,并在台上停留2min。如果2min未能找到,则将实验动物放在平台上2min,潜伏期记录为120s。每日以豚鼠4次训练潜伏期的平均值作为豚鼠当日的学习成绩。
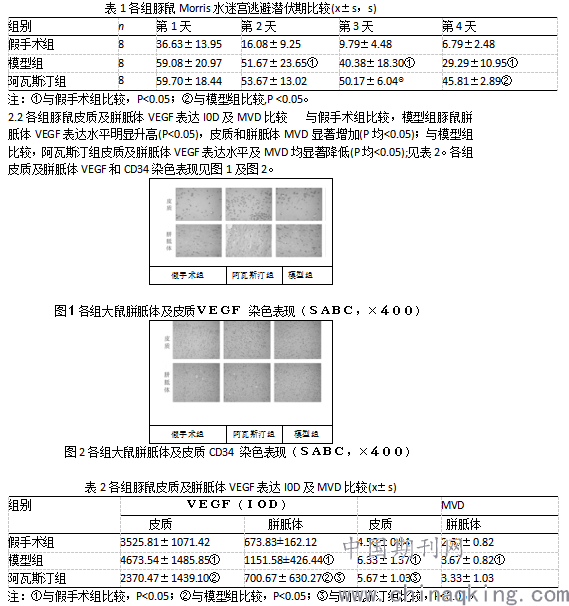
1.5.2皮质及胼胝体VEGF及CD34表达情况 Morris水迷宫实验结束后,麻醉豚鼠取脑组织,4%多聚甲醛固定,石蜡包埋制片,常规脱蜡及抗原修复,按试剂盒说明书逐步进行免疫组化染色,用SABC法。VEGF蛋白在细胞浆表达,阳性细胞可见棕黄色或様褐色颗粒,ImageProPlus医学图像分析系统进行图像分析,400倍镜下,随机取3个视野,测出VEGF阳性反应细胞的积分光密度(IOD)。CD34阳性染色时细胞内有浅棕色至深棕色颗粒沉着,每张染色切片于低倍镜下(x40)寻找3个微血管密集区,随后于高倍镜下(x200)计数5个不同视野中的微血管数,取平均值代表MVD值。
1.6统计学方法采用SPSS21.0统计软件进行统计学处理。所得数据均采用x±s表示,组间比较采用单因素方差分析。Morris水迷宫定位航行实验潜伏期数据采用重复测量数据的方差分析,若不满足球对称假设,则用Greenhouse-Geisser方法进行校正,若分组因素和时间因素存在交互效应,则进一步做单独效应分析;在单独效应分析中,同一时间点上各实验组间进行组间比较。P<0.05为差异有统计学意义。
2.结果
2.1各组豚鼠Morris水迷宫逃避潜伏期比较 随着豚鼠学习次数的增加,各组逃避潜伏期逐渐缩短。从第2天开始,模型组豚鼠潜伏期明显长于假手术组(P均<0.05);第3天和第4天,阿瓦斯汀组潜伏期均长于模型组(P均<0.05)。见表1。
3.讨论
VEGF作为一种重要的血管发育调节因子,是影响缺血后大脑重塑的重要调控因子之一[5]。脑缺氧缺血后,VEGF表达增高,与其受体结合促进血管内皮细胞增殖,诱导新生血管的生成,促进侧支循环建立,增加缺血区供血供氧,起直接保护作用[6]。CD34是一种阶段特异性白细胞分化抗原,选择性地表达于人类造血干细胞、祖细胞和血管内皮细胞表面,是一种与新生小血管相关的抗原,被作为最敏感的新生血管内皮标记物。本实验结果显示,阿瓦斯汀组豚鼠皮质及胼胝体VEGF表达水平和MVD均显著低于模型组,提示阿瓦斯汀可抑制VEGF表达,阻断VEGF的促增殖作用,阻碍脑微血管生成,从而加重皮质及白质缺血区血供,这可能是其加重AD豚鼠模型病理学改变的机制之一。
有研究[7-9]指出参与AD新生血管形成的细胞因子至少有20多种,包括血管内皮生长因子(VEGF)、血小板衍生生长因子、肿瘤坏死因子、转化生长因子等。生理状况下血管生成促进因子和血管生成抑制因子之间维持平衡,新生血管的形成归因于此平衡的破坏,其中VECF是重要的始动因素。VEGF及其受体系统在脑微血管形成过程中起着非常重要的作用。保持VEGF的水平是确保AD脑血液供应、维持和保护神经功能必不可少的。阿瓦斯汀是全长的VEGF单克隆抗体,相对分子质量约149X103,由约93%的人类Igc和7%的鼠源性抗体组成基本序列[10-11]。阿瓦斯汀与VEGF有2个结合位点,能结合和阻断所有VEGF的异构体[12]。同时,阿瓦斯汀阻止VEGF与内皮细胞表面的VECFR1和VECFR2受体结合,使内源化VEGF的生物活性失效,抑制内皮细胞有丝分裂,减少血管通透性,从而阻断新生血管的形成[13]。
本次研究表明,与假手术组比较,阿瓦斯汀组豚鼠逃避潜伏期明显延长(P<0.05),胼胝体VEGF表达水平降低(P<0.05),皮质和胼胝体MVD显著降低(P均<0.05);与模型组比较,阿瓦斯汀组豚鼠逃避潜伏期延长(P<0.05),皮质及胼胝体VEGF表达水平、MVD均显著降低(P均<0.05)。综上所述,阿瓦斯汀能下调AD豚鼠脑组织VEGF表达,抑制脑组织微血管再生及修复,因而加剧栓塞后AD样神经病理,这可能是其加剧栓塞后AD样症状的机制之一。
参考文献
[1]Wu Xiaoyun,Wynne Chris,Xu Chenchao,Gan Yiting,Wang Chaohe,Thomas Bert E,Yu Jin-Chen,Li Shengfeng,Zhang Li. A Global Phase I Clinical Study Comparing the Safety and Pharmacokinetics of Proposed Biosimilar BAT1706 and Bevacizumab (Avastin?) in Healthy Male Subjects.[J]. BioDrugs : clinical immunotherapeutics, biopharmaceuticals and gene therapy,2019.
[2]Ghoz Noha,Britton John,Ross Andrew R,Mohammed Imran,Hogan Emily,Said Dalia G,Dua Harminder S. Management of primary pterygium with intra-lesional injection of 5 flurouracil and bevacizumab (Avastin).[J]. Eye (London, England),2019.
[3]Reinmuth Niels,Bryl Maciej,Bondarenko Igor,Syrigos Kostas,Vladimirov Vladimir,Zereu Manuela,Bair Angel H,Hilton Fiona,Liau Katherine,Kasahara Kazuo. PF-06439535 (a Bevacizumab Biosimilar) Compared with Reference Bevacizumab (Avastin?), Both Plus Paclitaxel and Carboplatin, as First-Line Treatment for Advanced Non-Squamous Non-Small-Cell Lung Cancer: A Randomized, Double-Blind Study.[J]. BioDrugs : clinical immunotherapeutics, biopharmaceuticals and gene therapy,2019.
[4]Cohen Deborah. Avastin: drug regulator clears way for use for wet AMD.[J]. BMJ (Clinical research ed.),2019,366.
[5]Reinmuth Niels,Bryl Maciej,Bondarenko Igor,Syrigos Kostas,Vladimirov Vladimir,Zereu Manuela,Bair Angel H,Hilton Fiona,Liau Katherine,Kasahara Kazuo. PF-06439535 (a Bevacizumab Biosimilar) Compared with Reference Bevacizumab (Avastin?), Both Plus Paclitaxel and Carboplatin, as First-Line Treatment for Advanced Non-Squamous Non-Small-Cell Lung Cancer: A Randomized, Double-Blind Study.[J]. BioDrugs : clinical immunotherapeutics, biopharmaceuticals and gene therapy,2019,33(5).
[6]Styles Caroline J,Ramsay Alan,Christie Emily. Comment on 'Consulting the consultants: Avastin in the treatment of wet AMD'.[J]. Eye (London, England),2019,33(11).
[7]Ghoz Noha,Britton John,Ross Andrew R,Mohammed Imran,Hogan Emily,Said Dalia G,Dua Harminder S. Management of primary pterygium with intra-lesional injection of 5 flurouracil and bevacizumab (Avastin).[J]. Eye (London, England),2019,33(11).
[8]Mohamed R,Saunders D C,Mathews J P. Response to "Comment on 'Consulting the consultants: Avastin in the treatment of wet AMD'".[J]. Eye (London, England),2019,33(11).
[9]Mesonzhnik N V,Kuznetsov R M,Postnikov P V,Bochkareva N L,Markin P A,Kurynina K O,Appolonova S A. [Authentication study of the preparation 'Avastin' by means of chemical-toxicological analysis].[J]. Sudebno-meditsinskaia ekspertiza,2019,62(5).
[10]Wu Xiaoyun,Wynne Chris,Xu Chenchao,Gan Yiting,Wang Chaohe,Thomas Bert E,Yu Jin-Chen,Li Shengfeng,Zhang Li. A Global Phase I Clinical Study Comparing the Safety and Pharmacokinetics of Proposed Biosimilar BAT1706 and Bevacizumab (Avastin?) in Healthy Male Subjects.[J]. BioDrugs : clinical immunotherapeutics, biopharmaceuticals and gene therapy,2019,33(3).
[11]Li Cheryl S W,Sweeney Kevin,Cronenberger Carol. Population pharmacokinetic modeling of PF-06439535 (a bevacizumab biosimilar) and reference bevacizumab (Avastin?) in patients with advanced non-squamous non-small cell lung cancer.[J]. Cancer chemotherapy and pharmacology,2019.
[12]Tsiros Divyabharathy,Sheehy Casey E,Pecchia Surenna,Nugent Matthew A. Heparin potentiates Avastin-mediated inhibition of VEGF binding to fibronectin and rescues Avastin activity at acidic pH.[J]. The Journal of biological chemistry,2019,294(46).
[13]. Genentech; Genentech's Tecentriq in Combination With Avastin Increased Overall Survival and Progression-free Survival in People With Unresectable Hepatocellular Carcinoma[J]. Biotech Business Week,2019.