石继伟①,姚婷②,张慧杰②,陈敏②
镇江市食品药品监督检验中心①,江苏大学附属医院②,镇江,212004
摘要 目的:采用HPLC-DAD快速有效地测定患者血浆中亚胺培南的浓度,为感染性休克患者调整剂量提供依据。方法:前处理采用6%高氯酸-乙腈(1:1)沉淀萃取,采用 OMNI Zinger C18色谱柱;柱温:30℃,流动相:甲醇-10mmol/L磷酸二氢钾溶液(5:95),流速:1.0mL/min,检测波长:295nm,进样量:20 μL;二极管阵列检测。内标法定量,5-溴脲嘧啶为内标。 结果:亚胺培南在 0.5~100mg/L内线性关系良好,r=0.9996,定量限为0.5mg/L;相对回收率为88.17~94.22%,绝对回收率为78.35~85.27%;日内和日间RSD均<10%。结论:本方法准确、简便,符合亚胺培南药物浓度监测的要求,可用于调整患者的用药剂量。
关键词 亚胺培南;血浆;血药浓度;高效液相色谱法;感染性休克
亚胺培南为碳青霉稀类光谱抗菌药物,对β-内酰胺酶稳定,临床用于耐β-内酰胺类的革兰氏阳性菌和革兰氏阴性菌引起的感染[1],目前已成为重症感染最主要的药物之一。作为时间依赖性抗菌药,其最佳抗菌活性要在2次给药间隔40%(40%T>MIC),而对于重症感染和多重耐药菌感染时甚至要达到100%以上[2]。但大剂量治疗严重感染时,容易引起耐药性,还易引起惊厥、意识障碍等严重中枢神经系统不良反应[3]。感染性休克患者,因严重感染或伴有肾功能衰竭,其体内药物分布和半衰期等药代动力学参数因病理因素发生改变,血药浓度更加难以预测[4]。因此,在临床中有必要对亚胺培南的血药浓度进行监测,以确保其安全有效。
亚胺培南的检测方案国内外文献报道较少,主要采用HPLC-MS和HPLC法[5-6]。HPLC-MS法仪器成本较高,难以普及。故本实验采用HPLC法,对本科室感染性休克患者血药浓度进行监测,为及时调整个性化给药方案提供依据。
1 材料与方法
1.1仪器、对照品和试剂
1260高效液相色谱仪(美国安捷伦公司),BP211D电子分析天平(德国赛多利斯公司),NU超纯水系统(南京优普公司),高速冷冻离心机(美国贝克曼公司),涡旋混匀器(美国S1公司)
亚胺培南对照品购自美国Aladdin公司,纯度≥98.0%;内标物:5-溴脲嘧啶(Sigma公司纯度≥99.0%;甲醇、乙腈(色谱纯,德国Merck公司);尿素、高氯酸、磷酸二氢钾、二氯甲烷等均为分析纯,购自国药集团。
1.2溶液配制
1.2.1 对照品溶液 精密称取亚胺培南对照品适量,用稳定剂(3%尿素)配成浓度为1g/L的储备液。用稳定剂稀释,配制成浓度为5、10、20、50、100、200、500、1000mg/L的系列对照品溶液。
1.2.2 内标溶液的配制 精密称取5-溴脲嘧啶适量,用水稀释成浓度为500mg/L的内标溶液。
2 方法与结果
2.1色谱条件 采用OMNI Zinger C18(250mm×4.6mm,5μm)色谱柱;柱温:30℃,进样量:20μL,流动相:甲醇-10mmol/L磷酸二氢钾溶液(用三乙胺调pH到6)(5:95),流速:1.0mL/min,检测波长:295nm。血浆中内源性杂志均不影响亚胺培南与内标物的分离,亚胺培南的保留时间约为6.40min,内标物的保留时间约为9.81min,结果见图1
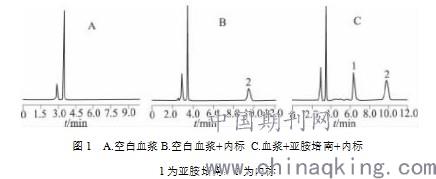
1为亚胺培南,2为内标
2.2样本前处理 精密吸取血浆样品180μL,置1.5mL EP管中,加入浓度为 500 mg/L的5-溴脲嘧啶20μL,加入6%高氯酸-乙腈(1:1)200μL,涡旋震荡30s,静置10min,13000r/min离心20min,吸取上清液400μL于1.5mL EP管中,加入二氯甲烷 500μL,涡旋1min,13000r/min离心10min,吸取上清液 20μL进样。
2.4 标准曲线与定量限 精密吸取不同浓度的系列对照品溶液各20μL 与180μL空白血浆混合,使亚胺培南的浓度分别为0.5,1.0,2.0,5.0,10.0,20.0,50.0,100.0 mg/L,按“2.1”项下色谱条件进样,以亚胺培南的峰面积(As)与内标峰面积(Ai)之比(Y)对亚胺培南浓度(X)进行回归,得到回归方程Y=0.0157X+ 0.0023,r=0.9996。结果表明,亚胺培南在0.5~100 mg/L范围内线性关系良好,标准曲线的最小浓度0.5mg/L设为定量限。
2.5 精密度试验 取空白血浆,分别配制浓度为0.5,1,10,50,100的样品各5份,按“2.1”项下方法进样,连续测定5次计算日内精密度;连续测定5d,计算日间精密度。结果见表1。
2.6 回收率试验 取“2.5”项下的溶液,加入相应浓度的亚胺培南对照品和内标物质溶液,不经沉淀,直接进样,计算绝对回收率。另取“2.5”项下的溶液,按“2.2”项下的方法处理后进样,计算相对回收率。结果见表1。
.jpg)
2.7稳定性试验 取空白血浆,配制浓度为50mg/L的标准品5份,经“2.2”项下处理后,在室温下分别放置 4、24、48 h,分别进样测定,计算变异系数(CV%);将配制好的样本,置于4℃保存,分别1周和1个月后复测3次,计算CV%。结果显示,亚胺培南稳定性良好,CV%均<10%。
3 临床应用
选自2020年10月以来本科室6例感染性休克患者,采用本方法测定患者血浆中亚胺培南浓度,样本取连续给药4剂后、用药前 0~30 min患者的血浆,测定谷浓度,结果见表2。
经验性治疗患者,亚胺培南以谷浓度1mg/L为临床有效和安全指标范围。根据测定结果调整治疗方案:(1)谷浓度≤1 mg/L,增加给药频次、增加给药剂量或延长滴注时间;(2)1 mg/L<谷浓度≤8mg/L,维持原给药方案;(3)谷浓度>8 mg/L,减少给药频次,或减少给药剂量。
.jpg)
结果表明,6例患者中需要增加血药浓度2例,需要减少血药浓度1例。同样也看出,患者血浆中亚胺培南的浓度有较大的个体差异,因此对其进行监测非常重要。
4 讨论
4.1处理方法的选择
样本处理方法直接影响HPLC法的分离效果,常用的处理方法有固相萃取法和直接沉淀法。本研究对比了两种处理方法的差异,结果显示,两种处理方法没有显著性差异。因此选用了更简便、省时、省事的直接沉淀法。
沉淀提取剂的选择也直接影响测量结果,本研究选用了甲醇、三氯甲烷、乙腈、6%高氯酸和乙腈的各种比例。综合沉淀反应速度、分离度、回收率等因素,最终选用了6%高氯酸-乙腈(1:1)作为沉淀提取剂。其反应时间适中,静置10min后离心效果佳,分离度好,回收率最高。
本研究试验了多种内标,如帕尼培南、美罗培南、异烟肼、氟脲嘧啶、5-溴脲嘧啶、甲硝唑等。经过综合比对,5-溴脲嘧啶和亚胺培南的分离度最好,且不受血浆中内源性杂质的干扰,故选用5-溴脲嘧啶做为内标。
4.2 临床应用
本方法样本处理简单,准确,灵敏,重复性好,可用于感染性休克患者亚胺培南血药浓度的快速监测,可以为个体化给药方案的制定提供了技术检测依据。但限于时间短、样本量有限,研究深度不足。对于如何指导临床调整用药方案,以及对感染性休克患者病情的恢复、并发症的减少、住院时间和费用的减少、满意度提高等方面还需要进一步的研究和探寻。
参考资料:
[1] ACAR J F, GOLDSTEIN F W, KITZIS M D, et al.Activity of imipenem on aerobic bacteria[J].J Antimicrob Chemother, 1983, 12 (Suppl D) :37-45.
[2] 王明贵(译).广泛耐药革兰阴性菌感染的实验诊断、抗菌治疗及医院感染控制:中国专家共识[J].中国感染与化疗杂志,2017,17(1):82-92
[3] YANG B F, SU D F. Pharmacology(药理学) [M]. 6th Ed. Beijing: People’s Medical Publishing House, 2004: 403.
[4] BELZBERG H, ZHU J, CORNWELL E E, et al. Imipenem levels are not predictable in the critically ill patient [J]. Trauma, 2004, 56(1): 111-117.
[5]XU Y, XIE W, MILLER-STEIN C M, et al. Hydrophilic interaction chromatography mass spectromery for the simultaneous determination of three polar non-structurally related compounds, imipenem, cilastatin and an intestigational beta-lactamase inhibitor, in biological matrices [J]. Rapid Common Mass Spectrom, 2009, 23(14): 2195-2205.
[6] LIU Q S, MA W X, DAI Q, et al. Determination of imipenem in human plasma by HPLC [J]. Chin J Antibiotics(中国抗生素杂志), 1997, 22(5): 347-350.